Luego de un determinado tiempo notamos que las baterías de nuestros celulares ya no otorgan el mismo rendimiento. El motivo fundamental por detrás de esto es el mal uso en las cargas y descargas de estos dispositivos.
Si el lector desea consultar sobre el cuidado de baterías, puede saltear toda la explicación teórica que daremos al comienzo, aunque se recomienda para comprender el por qué sucede y poder aplicar mejor los consejos que daremos al final.
Empecemos por algunas cuestiones técnicas: reacciones químicas
Habitualmente identificamos a las reacciones químicas como procesos que involucran la ruptura y/o formación de enlaces químicos (por ejemplo el covalente del agua H2O).
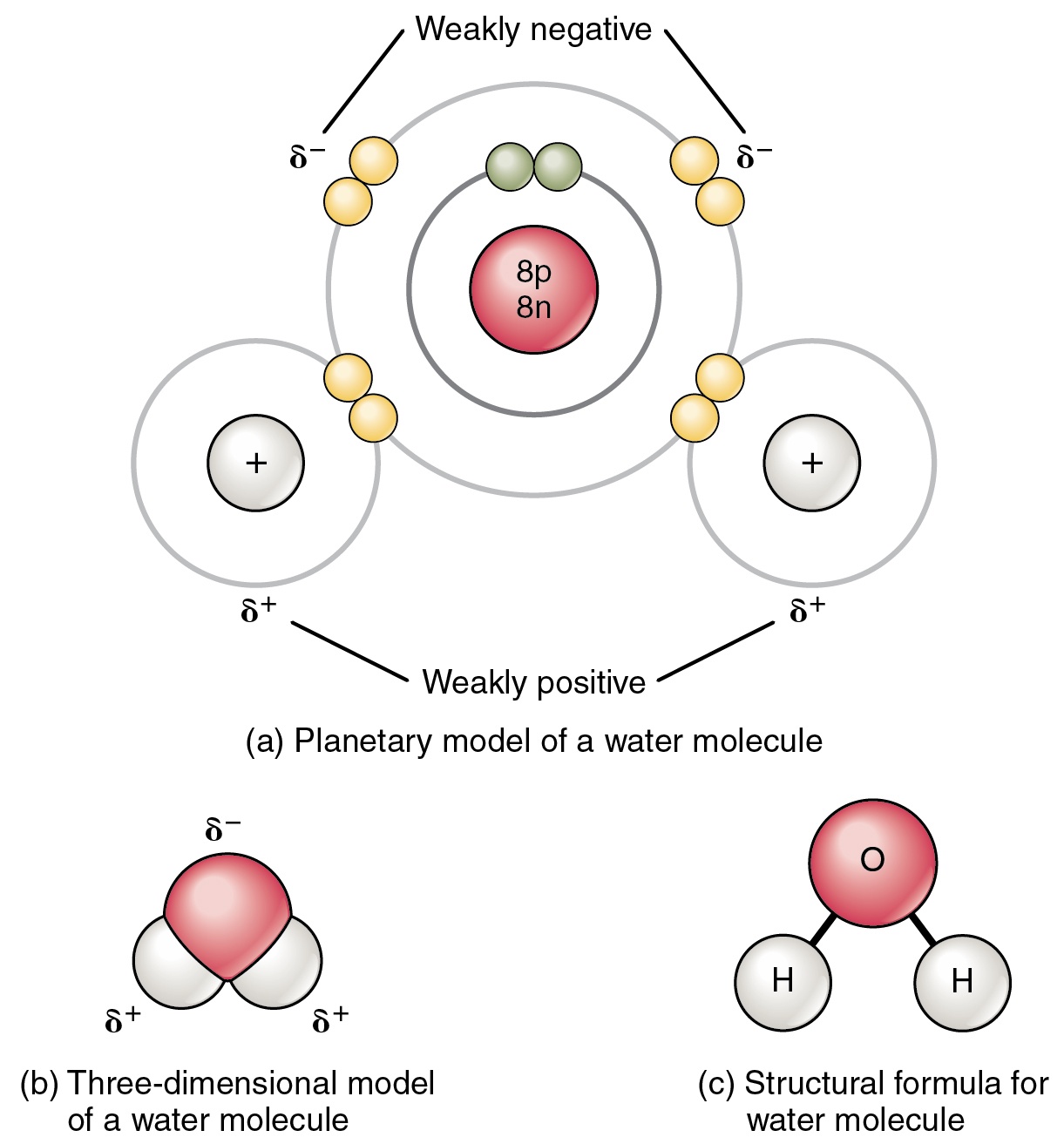
Sin embargo, la más elemental y ubicua de las reacciones químicas consiste simplemente en la transferencia de uno o más electrones desde una especie química donora (D) hacia una especie aceptora (A), sin que esto implique necesariamente reordenamientos de enlaces. Se define reducción al proceso de ganancia de electrones, y oxidación al proceso de pérdida de los mismos.
En base a estas definiciones, también es posible definir a una especie oxidante o reductora, como se resume en la Figura 2.
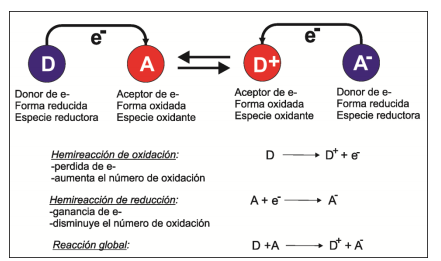
Dado que el proceso de transferencia electrónica implica la reducción del aceptor y la oxidación del donor, a estas reacciones se las denomina redox.
Las reacciones redox son centrales en procesos y fenómenos tan diversos como la síntesis de compuestos químicos, la producción, transducción y almacenamiento de energía, la electrónica molecular, la fotosíntesis natural y artificial, la respiración celular, la metalurgia, la orfebrería, la minería, la formación y movilización de minerales, los procesos de corrosión y el análisis químico, entre otros muchos ejemplos.
Electrólisis: el proceso que por medio de una reacción química le da vida a las baterías
Una pila es un dispositivo que permite generar una corriente eléctrica a partir de una reacción (redox) espontánea. ¿Será posible realizar reacciones no espontáneas proveyendo una diferencia de potencial?. Antes de responder definamos algunos conceptos. Se define diferencia de potencial (también denominada tensión eléctrica)?? al trabajo requerido, por unidad de área, para transportar una carga de un punta «a» a un punto «b».
La respuesta, ahora sí, la tenemos en varios procesos industriales, como la producción de aluminio donde haciendo circular electrones (aplicando una diferencia de potencial) se reduce el óxido de aluminio. Hacer este proceso por vía térmica requeriría trabajar a temperaturas muy altas.
Este proceso, en el cual se fuerza una reacción redox no espontánea aplicando al sistema una diferencia de potencial mediante una fuente externa, se denomina electrólisis, y el dispositivo en el que se realiza la operación se llama celda o cuba electrolítica. La recarga de pilas y baterías (varias pilas conectadas en serie) es sólo una de las aplicaciones posibles de la electrólisis, pero existen muchas otras.
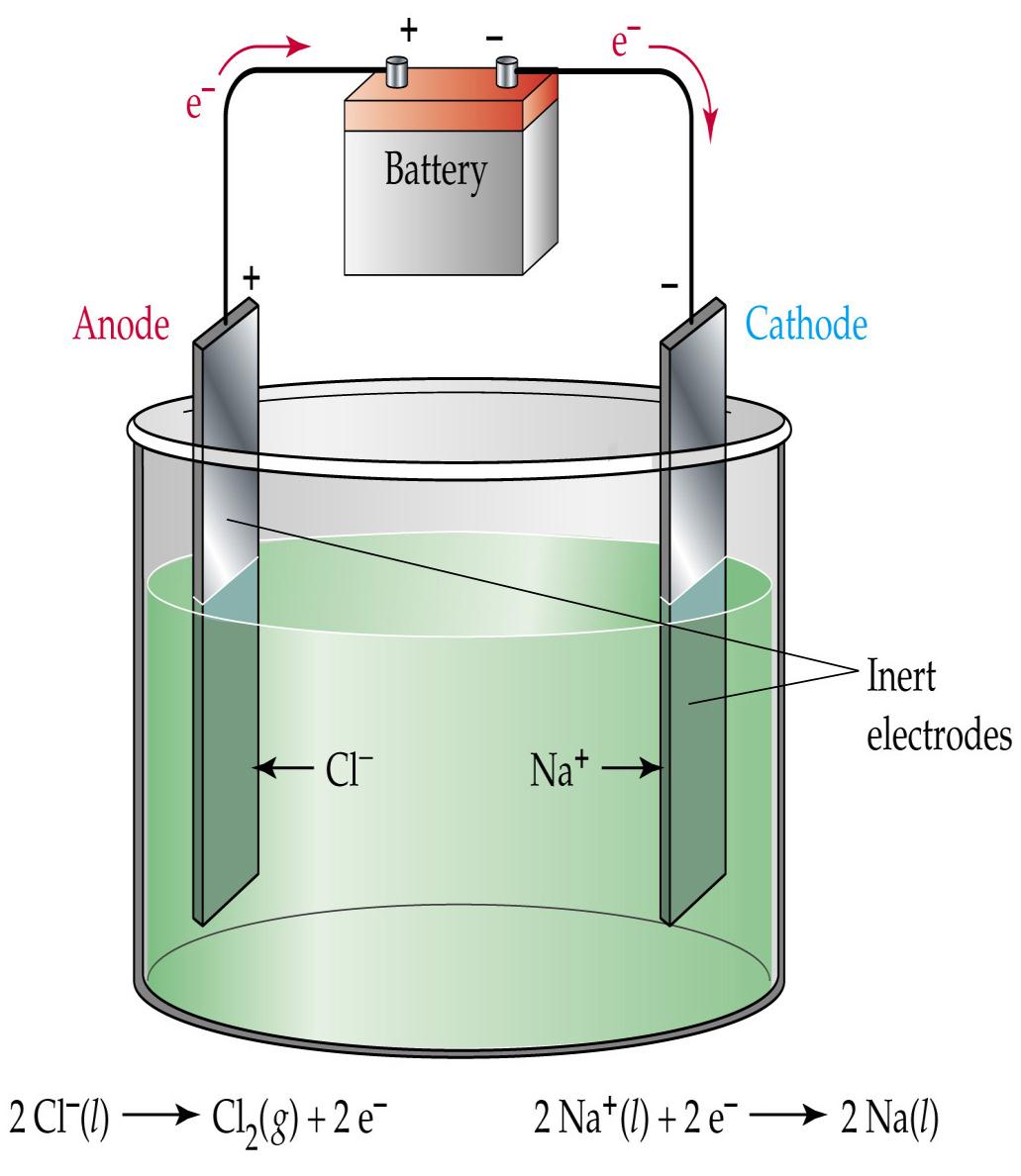
Imaginemos que se dispone de un recipiente (celda o cuba) que contiene una solución de un electrolito o un compuesto iónico fundido. Si se sumergen dos electrodos inertes (por ejemplo de platino o grafito) y, mediante una fuente externa, se aplica una diferencia de potencial suficientemente grande, se verificará circulación de corriente eléctrica debido al movimiento de los iones dentro de la cuba y al de electrones en los cables conductores.
Los cationes se dirigirán hacia el polo negativo (cátodo) y los aniones hacia el polo positivo (ánodo). Sobre cada interfaz electrodo/electrolito tendrán lugar reacciones heterogéneas de transferencia electrónica: del electrodo hacia los cationes en el cátodo (reducción) y de los aniones hacia el electrodo en el ánodo (oxidación). Naturalmente, la diferencia de potencial que debe aplicarse para que efectivamente ocurra la reacción dependerá del potencial estándar de reducción de cada especie y de su concentración.
Michael Faraday (1791-1867), uno de los científicos más grandes de todos los tiempos, descubrió que existe una relación simple entre la cantidad de sustancia que se produce o consume en un electrodo durante la electrólisis, y la carga eléctrica que circula por la celda. Las conclusiones a las que llegó pueden resumirse en dos leyes:
1) La cantidad de reacción química (consumo de reactivos, formación de productos) producida durante la electrólisis es proporcional a la carga eléctrica que circula por los electrodos.
2) La carga eléctrica requerida para depositar o liberar una masa w de un ion es proporcional a su carga z y a la masa w, e inversamente proporcional a su masa iónica relativa, Mr:
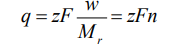
donde n es el número de moles del ión depositado y F es la carga de un mol de electrones.
A medida que la pila se utiliza para realizar trabajo eléctrico, el agotamiento paulatino de los reactivos y la acumulación de productos hará que el sistema se acerque al equilibrio (la diferencia de potencial tiende a 0V) y, por lo tanto, la pila dejará de funcionar.
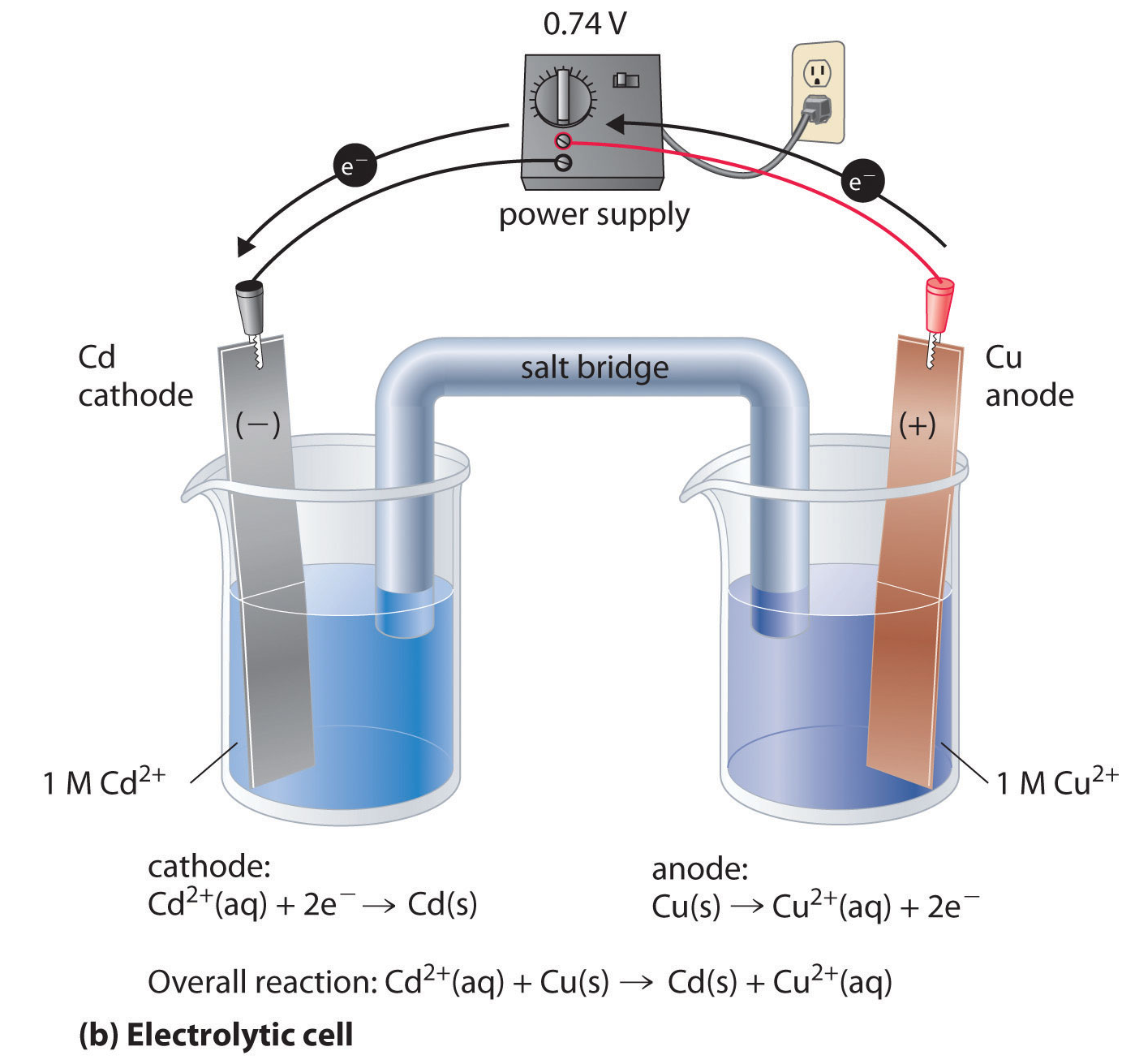
Una de las aplicaciones de la electrólisis es el desarrollo de baterías recargables como la de los automóviles, notebooks, celulares, etc. Cuando operan como pilas va disminuyendo la diferencia de potencial porque los reactivos se consumen. Al conectarlas a una fuente eléctrica, los reactivos se regeneran a partir de los productos por electrólisis.
¿Por que se degradan nuestras baterías?
Estas reacciones redox de las que hablamos anteriormente no se pueden dar indefinidamente. Después de cientos de ciclos de carga-descarga, el material de los electrodos se va debilitando y degradando progresivamente lo cual hace que las baterías pierdan capacidad a medida que se utilizan, disminuyendo la autonomía del producto e incluso hasta dejar de funcionar. Esta degradación de los electrodos depende del tipo de tecnología y de las condiciones de uso.
Actualmente, la investigación de mejores baterías se centra en la tecnología de iones de litio puesto que es el elemento químico que más tensión genera al producirse la reacción redox: 3,7 V. Donde se está trabajando para mejorar la capacidad de las actuales baterías es en los electrodos.
Cuidado de las baterías: medidas para lograr una mayor duración a futuro
Hablábamos que la degradación de los componentes de la batería depende entre otras cuestiones de las condiciones de uso. Uno de los factores que más afectan a las baterías es la temperatura.

En general se aconseja el uso de las baterías a temperaturas de 0 a 40ºC, fuera de ese rango de temperatura, la batería estará trabajando en condiciones adversas y generará una disminución de la autonomía. Incluso, a temperaturas muy altas, podría llevar a la batería a un punto inestable y podría explotar (hablamos de más de 60ºC). Con lo cual se aconseja tener especial cuidado con dejar los equipos al sol directo en verano o dentro de un automóvil por ejemplo, donde las temperaturas pueden estar cerca de esos valores.
Particularmente con los celulares, no solo debemos tener cuidado a la hora de exponer la batería a temperaturas ambientes altas sino también por altas cargas de trabajo al CHIPSET, lo que puede generar temperaturas altas y comprometer la batería a largo plazo. Esto no lleva a indicar que no se use el equipo si se está cargando al mismo tiempo ya que aumenta aún más la temperatura.

Las cargas rápidas en algunos casos también pueden perjudicar al futuro funcionamiento de las baterías. El hecho de aumentar la velocidad supone aumentar o bien la tensión o bien la corriente aumentando la temperatura del equipo. Algunas marcas logran modular esto, aumentando mayormente la temperatura del transformador, como por ejemplo OnePlus.
Por otro lado las baterías, según la mayoría de los fabricantes de Smartphones, funcionan idealmente entre un 20 y 80% de carga, es decir, que si mantenemos la batería dentro de estos valores, podremos extender su capacidad máxima por más tiempo debido a que no se gastarán tan rápidamente los ciclos de vida útil de la misma.
Los ciclos de vida útil determinan cuántas cargas-descargas soportará la batería del producto hasta comenzar a presentar fallas o desperfectos. Estos ciclos de carga media suelen ser de 300 a 500 en los smartphones y se completan una vez que el equipo consume el 100% de la batería, es decir, que si consumimos de 50 a 0% se gastará medio ciclo. No obstante, el hecho de consumir los 500 ciclos no quiere decir necesariamente que la batería deje de funcionar, sino que no lo hará idealmente. Eventualmente luego de muchos años, podría dejar de funcionar pero eso depende mucho de cada batería y las condiciones a la que haya sido expuesta. Por ejemplo, tenemos un Motorola Moto X de primera generación que ha cumplido 7 años de ciclos y aún continúa funcionando, logicamente con una autonomía considerablemente inferior.

Por lo tanto, un celular con mayor capacidad de batería, que tarda más en gastar su ciclo, tendrá una vida útil mayor respecto a otro con capacidad menor. En consecuencia recomendamos pensar bien qué Smartphone comprar y tratar de elegir el de mayor capacidad. Hoy en día para un equipo de 6.5″ idealmente se recomienda entre 4500 y 5000 mAh.
Otro consejo útil para cuidar las baterías es cargarlas idealmente con el equipo apagado. Cargarlo prendido puede resultar más complejo para la electrónica en calcular los voltajes y las corrientes que necesita la batería, lo cual puede dar lugar a potenciales sobrecalentamientos.
Por su parte, tener cuidado con las carcasas protectoras ya que algunas son demasiado cerradas y no permiten que el calor se disipe naturalmente del equipo, lo cual podría generar sobrecalentamientos y dañar la batería.
Asimismo, nos consultan frecuentemente si es perjudicial tener el celular cargando toda la noche. Antes de responder considerar que los celulares cada vez vienen con cargas rápidas más veloces que permiten completarla en menos de una hora en muchos casos. Pero contestando la pregunta, el equipo no se verá dañado, pero considerar que una vez alcanzado el 100%, éste comenzará a descargarse y cargarse nuevamente de modo tal que continúe cerca de ese 100%. Este proceso comenzará a gastar, en muy menor medida, los ciclos de carga de los cuales estuvimos hablando anteriormente. Hacerlo una noche no será mayor problema, pero si podría serlo si extendemos el hábito por mucho tiempo.
¿Y qué sucede si por algún motivo dejó de usar mi equipo (ya sea celular, tablet, notebook etc)? Es importante que no se deje descargado por demasiado tiempo ya que podría sufrir una sobredescarga (cuando el equipo se apaga, éste realmente no queda en 0%, sino cerca de ese valor pero aún así, continúa descargándose y podría llegar a 0%) pudiendo quedar la batería totalmente obsoleta. En algunos casos es posible revivirla con un shock eléctrico pero no siempre es posible. Se recomienda dejarla cargada al 50 o 60% por seguridad antes de dejarla apagada sin uso por varios meses.
Por último mencionar que los fabricantes recomiendan usar los cargadores propietarios, correspondientes a cada equipo, considerando que fueron pensados específicamente para ese equipo y esa batería. No obstante podremos usar otros cargadores, pero recomendamos que sean de marcas de referencia. Los cargadores Tronsmart son una alternativa a los que podemos tener de las marcas conocidas de celulares.
CONCLUSIÓN
Cuidar las baterías resulta ser imprescindible si lo que queremos es extender su vida útil lo máximo posible. Acciones como mantener la carga entre un 20 y 80% o mantener la exposición del equipo dentro de un rango de temperaturas aceptable puede ayudar mucho en ese objetivo.
De todos modos lo más importante es generar un hábito en los cuidados, pero no sobre estresarnos por estas cuestiones. El equipo está preparado para trabajar entre 0 y 100% y a temperaturas incluso por fuera de los límites que comentamos antes. Lo más importante es no someter al producto constantemente a los límites para poder extender más la autonomía en el tiempo.
Consejos:
- Usar cargadores de marca y propietarios de cada equipo.
- Utilizar el equipo con batería entre 20 y 80%.
- No dejar apagado el equipo por más de medio año, y hacerlo al comienzo con un 50% restante.
- No cargar idealmente el equipo con carcasas protectoras sin salidas de aire.
- Utilizar las cargas rápidas siempre que sea necesario (esto se puede elegir desde la configuración).
- No exponer los equipos a temperaturas de más de 40ºC o menos de 0ºC.
- Dejar reposar el equipo si notamos que la temperatura aumenta en exceso por tareas exigentes.
Bibliografía:
- QUÍMICA GENERAL. Petrucci, Herring, Madura, Bissonnette. 10° Edición. Pearson. ISBN: 9788483226803.
- PRINCIPIOS DE QUÍMICA: LOS CAMINOS DEL DESCUBRIMIENTO. Atkins, Jones. 3° Edición. Editorial Médica Panamericana. ISBN 9789500601672.
- QUÍMICA. Chang. 9° Edición. McGraw-Hill. ISBN: 970106111X.
- QUÍMICA. CURSO UNIVERSITARIO. Mahan, Myers. 4° Edición. Addison Wesley. ISBN: 9684443595.







